Круговые процессы (циклы). Цикл Карно. Второе начало (закон) термодинамики. Энтропия. Цикл Карно Кпд тепловой машины Карно
Для работы любой тепловой машины по замкнутому циклу необходима внешняя среда, которую условно можно представить себе как два тела - нагреватель Т mах, и холодильник , находящийся при температуре T min (T min < Т mах ). Предполагается, что при контакте с нашей системой температуры нагревателя и холодильника не меняются. При контакте с нагревателем система получает тепло, при контакте с холодильником - отдает его.
В термодинамике существует теорема Карно (рис. 5.2):
Рис. 5.2. Леонар Сади Карно (французский физик и военный инженер)
|
При заданных температурах нагревателя и холодильника максимально возможный КПД тепловой машины не зависит от природы рабочего тела машины и определяется формулой
|
Реализация максимально возможного КПД достигается в так называемом цикле Карно , когда идеальный газ проходит замкнутый цикл, составленный из двух адиабат и двух изотерм (рис. 5.3).

Рис. 5.3. Цикл Карно (обходится по часовой стрелке) - комбинация двух изотерм 1 - 2, 3 - 4 и двух адиабат 2 - 3 и 4 - 1 ; теплообмен со средой осуществляется на изотермических участках цикла: на участке 1 - 2 газ получает теплоту Q 1 , а на участке 3 - 4 отдает теплоту Q 2
Убедимся, что показанный замкнутый процесс действительно имеет КПД, соответствующий формуле (5.5). Температура системы равна T 1 в точках 1, 2 и T 2 в точках 3, 4 . Значения остальных термодинамических параметров (р, V) будут иметь в качестве индекса номер соответствующей точки на диаграмме. Нам надо вычислить количества полученной Q 1 , и отданной Q 2 теплоты, найти совершенную газом работу А Ц = Q 1 – Q 2 и определить КПД цикла. Сразу заметим, что на участках 2-3 и 4-1 система не обменивается теплом с внешней средой. Следовательно, теплоту Q 1 газ получает на участке 1-2, а теплоту Q 2 отдает на участке 3-4. Рассмотрим подробнее различные участки цикла.
Изотерма 1 -2. На этом участке газ находится в контакте с нагревателем и происходит изотермическое расширение от объема V 1 до объема V 2 . Температура Т 1 не меняется, следовательно, не изменяется внутренняя энергия, а вся полученная теплота расходуется на совершение газом работы:
![]()
Величину работы газа при изотермическом процессе мы уже вычисляли ранее, так что с учетом формулы (2.13) находим
находим
|
|
Адиабата 2 -3. Здесь система отсоединяется от нагревателя и не обменивается теплом с внешней средой: Q 23 = 0 . Газ продолжает расширяться, но уже адиабатно. Работа совершается за счет внутренней энергии газа, и его температура падает до значения Т 2 . На этом участке цикла нам нужна информация, доставляемая уравнением адиабаты :
|
|
Изотерма 3 -4. Система подключается к холодильнику, и газ начинает сжиматься. Внутренняя энергия остается неизменной, над газом совершается работа (А 34 < 0 ), а выделяющееся
![]()
передается холодильнику. Имеем аналогично (5.6)
|
|
Адиабата 4 -1. Система отключена от внешней среды и продолжает сжиматься изотермически, что приводит к повышению ее температуры до Т 1 . В конечном итоге система возвращается в первоначальное состояние. Поскольку точки 4 и 1 лежат на адиабате, получаем связь объемов и температур, аналогичную (5.7):
|
|
Из уравнений (5.7) и (5.9) находим отношения объемов

откуда следует, что
Поэтому отдаваемую холодильнику теплоту Q 2 (см. уравнение (5.8)) можно записать как
|
|
Используя выражение (5.6) для теплоты, полученной системой, находим совершенную в ходе цикла работу
|
|
Из проведенного анализа следует также, что максимальная температура в цикле равна Т mах = Т 1 , а минимальная - Т min = Т 2 . Если разделить (5.12) на (5.6), то немедленно получим выражение (5.5) для КПД цикла Карно, из которого выпадают все параметры, кроме температур холодильника и нагревателя.
Пример 1. Котел тепловой станции работает при температуре около t 1 = 550 °С . Отработанное тепло отводится к реке при температуре около t 2 = 20 °С . Найдем максимально возможный КПД этой станции (рис. 5.4).

Рис. 5.4. Схема работы тепловой машины Карно
Поскольку в формуле для КПД цикла Карно используются абсолютные температуры, надо перейти от шкалы Цельсия к шкале Кельвина: Т 1 = 550 + 273 = 823 К , Т 2 = 20 + 273 = 293 К . Теперь находим КПД тепловой станции:
![]()
Конечно, реальный КПД станции заметно ниже.
Если цикл Карно осуществить в обратном направлении, то есть против часовой стрелки на рис. 5.2, то для определения эффективности холодильной установки надо использовать формулы (5.3), (5.4) и выражения (5.6), (5.11). Получаем тогда
|
|
Печально, но чем ниже температура внешней среды Т 1 , тем меньше мы нуждаемся в холодильнике, и тем эффективнее он работает.

Рис. 5.5. Схема работы холодильной установки
Приведем численный пример. Если кондиционер поддерживает в комнате температуру t 2 = 20 °С , а температура наружного воздуха равна t 1 = 30 °С , то для холодильного коэффициента имеем

а для КПД холодильника

Конечно, на самом деле температура тепловыделяющего элемента больше наружной температуры на 20–30 градусов, так что разность температур может достигать 30–40 градусов, что приводит к значениям

Напомним, что речь идет об идеальных установках, работающих по циклу Карно. Реальный типичный кондиционер потребляет мощность 750 Вт , перекачивая за час около 5 МДж тепловой энергии. Это значит, что за секунду кондиционер совершает работу А = 750 Дж и отнимает у воздуха в комнате теплоту
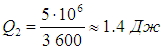
Отсюда находим
Мы видим, что реальный кондиционер гораздо менее эффективен, нежели идеальный холодильник Карно.
Пример 2. Пусть в домашнем холодильнике поддерживается температура t 2 = –3 °С (Т 2 = 270 К ), а температура в кухне равна t 1 = 27 °С (T 1 = 300 К ). Пусть далее мотор холодильника потребляет мощность N = 200 Вт . Предполагая, что холодильник работает по циклу Карно и что тепловыделяющий элемент имеет температуру окружающего воздуха, определим мощность потока тепловой энергии, перекачиваемой из камеры холодильника в кухню.
За время t мотор совершит работу
КПД холодильника равен

откуда находим количество теплоты, поступающее в кухню в единицу времени:

Обратите внимание, что холодильник работает как весьма эффективный обогреватель помещения. Надо только оплачивать потребляемую мотором мощность 200 Вт , а в кухню поступит в 10 раз большая энергия, 90 % которой перекачивается из камеры холодильника (90 % - КПД холодильника в этом примере). Любопытно, что если бы вместо холодильника был включен обогреватель той же мощности, то он нагревал бы помещение в 10 раз слабее.
Наши численные оценки можно рассматривать как пример теплового загрязнения окружающей среды, свойственного технической цивилизации.
Дополнительная информация
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - Я. де Бур Введение в молекулярную физику и термодинамику, Изд. ИЛ, 1962 г. - стр. 202–205, ч. 2, гл. 2, § 10: описан процесс ожижения газа Клода - Гейландта.2.3.1. Обратимые и круговые процессы
Обратимым процессом называется такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же термодинамические состояния, что и при прямом процессе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
Обратимый процесс обладает следующим свойством: если при прямом ходе на каком-то элементарном участке система получает тепло dQ и совершает работу dA, то при обратном ходе на том же участке система отдает тепло dQ" = dQ и над ней совершается работа dA" = dA. По этой причине после протекания обратимого процесса в одном, а затем в обратном направлении и возвращения системы в первоначальное состояние в окружающих систему телах не должно произойти никаких изменений.
Круговым процессом (циклом) называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние. На графике цикл изображается замкнутой кривой (Рис. 2.3.1).
Рис. 2.3.1. Круговой термодинамический процесс
Работа, совершаемая при круговом процессе, численно равна площади, охватываемой кривой. Действительно, работа на участке 1-2 положительна и численно равна площади, отмеченной наклоненной вправо штриховкой. Работа на участке 2-1 отрицательна и численно равна площади, отмеченной наклоненной влево штриховкой. Следовательно, работа за цикл численно равна площади, охватываемой кривой.
После совершения цикла система возвращается в исходное состояние.
2.3.2. Коэффициент полезного
действия тепловой машины
Всякий двигатель представляет собой систему, совершающую многократно некоторый круговой процесс (цикл). Пусть в ходе цикла рабочее вещество (например, газ) сначала расширяется до объема V 2 , а затем снова сжимается до первоначального объема V 1 (Рис. 2.3.2).

Рис. 2.3.2. К расчету кпд тепловой машины
Чтобы работа за цикл была больше нуля, давление (а, следовательно, и температура) в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу нужно в ходе расширения сообщать, а в ходе сжатия отнимать от него тепло.
Напишем первое начало термодинамики для обеих частей цикла. При расширении внутренняя энергия изменяется от значения U 1 до U 2 , при этом система получает тепло Q 1 и совершает работу А 1 . Поэтому выполняется:
При сжатии система совершает работу А 2 и отдает тепло Q 2 , что равносильно получению тепла Q 2 . Следовательно,
Складывая уравнения (2.3.1) и (2.3.2), получаем:
Поскольку А 1 + А 2 есть полная работа А, совершаемая системой за цикл, можно записать:
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной .
Первое начало термодинамики иногда формулируют так: периодически действующий вечный двигатель (перпетуум мобиле) первого рода, совершающий работу в большем количестве, чем он получает энергии извне, невозможен .
Как следует из (2.3.4), не все получаемое извне тепло Q 1 используется для получения полезной работы. Для того, чтобы двигатель работал циклами, часть тепла Q 2 должна быть возвращена во внешнюю среду и, следовательно, не используется по назначению. Очевидно, что чем полнее тепловая машина превращает получаемое извне тепло Q 1 в полезную работу А, тем эта машина выгоднее. Поэтому тепловую машину принято характеризовать коэффициентом полезного действия (КПД), который определяется как отношение совершаемой за цикл работы к получаемому за цикл количеству тепла Q 1:
Из определения КПД следует, что он не может быть больше единицы.
2.3.3. Второе начало термодинамики
Второе начало термодинамики, как и первое, может быть сформулировано несколькими способами. В наиболее очевидной формулировке второе начало гласит, что:
невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Более строго, невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Еще одна формулировка: невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества тепла и превращение этого тепла в работу полностью.
Работа может быть полностью превращена в тепло, например, посредством трения, обратное неверно.
2.3.4. Цикл Карно
Предположим, что какое-либо тело может вступать в теплообмен с двумя тепловыми резервуарами, имеющими температуры Т 1 и Т 2 и обладающими бесконечно большой теплоемкостью. Это означает, что получение или отдача этими резервуарами конечного количества тепла не изменяет их температуры. Выясним, какой обратимый цикл может совершать тело в таких условиях.
Рассматриваемый цикл может состоять как из процессов, в ходе которых тело обменивается теплом с резервуарами, так и из процессов, не сопровождающихся теплообменом с окружающей средой, т.е. происходящих адиабатически.
Процесс, сопровождающийся обменом тепла с резервуарами, может быть обратимым только в том случае, если в ходе этого процесса температура тела будет равна температуре соответствующего резервуара. Это - изотермический процесс, протекающий при температуре резервуара.
Обратимый цикл, совершаемый телом (или системой), вступающим в теплообмен с двумя тепловыми резервуарами бесконечно большой емкости, будет состоять из двух изотер (при температурах резервуаров) и двух адиабат. Это - цикл Карно .
Рассмотрим, как может быть осуществлен цикл Карно с газом в качестве рабочего вещества. Поместим газ в цилиндр, закрытый плотно пригнанным поршнем. Пусть стенки и поршень сделаны из непроводящих тепло материалов, дно цилиндра, напротив, изготовлено из материала с высокой теплопроводностью. Теплоемкость цилиндра и поршня считается бесконечно малой.
Пусть первоначально поршень занимает положение, отвечающее объему V 1 и температуре газа Т 1 . Поставим цилиндр на резервуар, имеющий температуру Т 1 , и предоставим газу возможность очень медленно расширяться до объема V 2 . При этом газ получит от резервуара тепло Q 1 (Рис. 2.3.3).

Рис. 2.3.3. Тепловая машина, работающая по циклу Карно
Затем снимем цилиндр с резервуара, закроем дно теплоизолирующей крышкой и позволим газу расширяться адиабатически до тех пор, пока его температура не упадет до значения Т 2 . Объем газа в результате станет равным V 3 . Убрав теплоизолирующую крышку, поставим цилиндр на резервуар, имеющий температуру Т 2 и сожмем газ изотермически до такого объема V 4 , чтобы при последующем адиабатическом сжатии при достижении температуры Т 1 объем получил значение V 1 (иначе цикл не замкнется). Наконец, снимем цилиндр с резервуара, закроем дно теплоизолирующей крышкой и, сжимая газ адиабатически, приведем его в первоначальное состояние (температура Т 1 , объем V 1).
Если газ идеальный, соответствующий цикл на (р-V) диаграмме имеет вид, показанный на Рис. 2.3.4.

Рис. 2.3.4. (р-V) диаграмма цикла Карно
2.3.5. КПД цикла Карно для идеального газа
Рассмотрим цикл Карно для идеального газа. КПД тепловой машины равен:
где Q 1 - тепло, получаемое за цикл от нагревателя, Q 2 - тепло, отдаваемое за цикл холодильнику.
При изотермическом процессе внутренняя энергия идеального газа остается постоянной. Поэтому количество полученного газом тепла Q 1 равно работе А 12 , совершаемой газом при переходе из состояния 1 в состояние 2 (Рис. 2.3.4). Эту работу можно рассчитать так:
Используя уравнение Клапейрона-Менделеева, получим:
где m - масса идеального газа а тепловой машине.
Количество отдаваемого холодильнику тепла Q 2 равно работе А 34 , затрачиваемой на сжатие газа при переводе его из состояния 3 в состояние 4. Эта работа равна:
Для того, чтобы цикл был замкнутым, нужно, чтобы состояния 4 и 1 лежали на одной и той же адиабате. Отсюда с помощью (2.1.68) можно получить:
Аналогично, поскольку состояния 2 и 3 лежат на одной и той же адиабате, выполняется:
Деля (2.3.11) на (2.3.10), приходим к условию замкнутости цикла:
Окончательно, учитывая условие (2.3.12), для КПД тепловой машины, работающей по циклу Карно для идеального газа, получаем:
Следовательно, КПД цикла Карно для идеального газа оказывается зависящим только от температуры нагревателя и холодильника.
Даже для наилучшей тепловой машины, работающей по циклу Карно, КПД всегда значительно меньше единицы. Если, например, температура нагревателя Т 1 = 373К (температура кипения воды), а температура холодильника Т 2 = 293К (комнатная температура), то η = 22%. И этот КПД является верхним (и недостижимым) пределом. В реальных машинах, например, на паровозах, редко превосходил 10%.
2.3.6. Энтропия
Обратим внимание на те изменения, которые претерпело рабочее тело в процессе кругового цикла Карно. Из исходного состояния 1 (давление р 1 , температура Т 1) рабочее тело путем последовательного проведения изотермического и адиабатического расширений перешло в состояние 3, когда оно приняло температуру холодильника Т 2 . Это изменение состояния произошло за счет тепла Q 1 , доставленного рабочему телу нагревателем. Обратный переход рабочего тела из состояния 3 в исходное состояние 1 был осуществлен двумя последовательно проведенными изотермическим и адиабатическим сжатиями тела. Выделившееся при этом возвращении в исходное состояние количество тепла равно Q 2 , причем Q 2 < Q 1 . Таким образом, оказывается, что обратимый переход одного и того же тела из состояния 1 → 3 и обратный переход 3 → 1 сопровождаются неодинаковыми количествами поглощенного и выделенного тепла. Очевидно, что это связано с тем, что оба перехода были проведены различными путями: в одном случае (1 → 3) процесс расширения происходил при давлении более высоком, чем процессы сжатия в другом (3 → 1). Ясно, что если бы мы осуществили переход 3 → 1 тем же путем, что и прямой, т.е. по кривой 3 → 2 → 1, а не по кривой 3 → 4 → 1 (), то количество тепла, затраченного при прямом переходе, в точности равнялось бы количеству тепла, выделившемуся при обратном переходе.
Отсюда следует важный вывод: количество тепла, которое должно быть доставлено телу или отнято у него при переходе из одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода.
Однако, хотя сами количества тепла - Q 1 , доставленного рабочему телу нагревателем при температуре Т 1 , и Q 2 , переданное рабочим телом холодильнику при температуре Т 2 , не равны между собой, то, как следует из сопоставления формул (), () и (), отношения этих теплот к тем температурам, при которых они были поглощены или отданы, численно равны между собой (но имеют противоположные знаки):
Отношение называют, следуя Лоренцу, приведенной теплотой . Из (2.3.15) следует, что приведенные теплоты, полученные и отданные рабочим телом при круговом процессе, равны между собой.
Обобщим данный результат. Любое изменение состояния тела или системы тел в общем случае можно представить как результат бесконечно большого числа бесконечно малых изменений. При каждом таком бесконечно малом изменении система либо поглощает, либо выделяет бесконечно малое количество тепла dQ (если процесс не адиабатический). Пусть dQ > 0, когда система поглощает тепло.где dQ - количество тепла, отнятое от тела М при температуре Т, dQ" - количество тепла, переданное резервуару с температурой Т 1 .
Если Т 1 < T, резервуар играет роль холодильника, а тело М - нагревателя, и наоборот.
После того, как телом М будет завершен круговой процесс, общее количествo теплоты, потерянное телом, как следует из (2.3.17), должно быть равно величине . Поскольку теплоемкость резервуара велика и его температура остается постоянной, эта величина будет равна: .
Процесс, совершенный телом, - круговой. Поэтому оно в конце концов не испытало никаких изменений. Если бы интеграл (2.3.16) оказался положительным, то это означало бы, что потерянное телом количество тепла целиком превратилось в работу, тогда как тело М своего состояния не изменило. Однако это противоречит второму началу термодинамики. Значит, предположение о том, что , несостоятельно. Аналогично можно показать, что указанный интеграл не может быть отрицательным. Но если он не может быть ни положительным, ни отрицательным, то это означает, что для обратимых круговых процессов выполняется:
Энтропия изолированной системы может только возрастать (если в системе протекает необратимый процесс), или оставаться постоянной в случае обратимого процесса.
Нернстом доказана теорема (иногда называемая третьим началом термодинамики), согласно которой при стремлении абсолютной температуры к нулю энтропия любого тела также стремится к нулю:
Тогда энтропию состояния тела при температуре Т можно вычислить так.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоречащих первому началу, в которых энергия сохраняется, а в природе они не осуществляются. Появление второго начала термодинамики - необходимость дать ответ на вопрос, какие процессы в природе возможны, а какие нет - определяет направление развития процессов.
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать наиболее краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
2.10 Тепловые двигатели и холодильные машины.
Цикл Карно и его коэффициент полезного действия
для идеального газа.
Изформулировки второго начала термодинамики по Кельвину следует, что вечныи двигатель второго рода – периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты, - невозможен. Для иллюстрации этого положения рассмотрим работу теплового двигателя.
Принцип действия теплового двигателя приведен на рис.63. От термостата с более высокой температурой T 1 , называемого нагревателем за цикл отнимается количество теплоты Q 1 , а термостату с более низкой температурой Т 2 , называемому холодильником , за цикл передается количество теплоты Q 2 , при этом совершается работа A=Q 1 –Q 2 .
Чтобы термический коэффициент полезного действия теплового двигателя был h =1, должно быть выполнено условие Q 2 =0, т.е. тепловой двигатель должен иметь один источник теплоты, а это невозможно. Так, французский физик и инженер Н. Л. С. Карно показал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами, иначе это противоречило бы второму началу термодинамики.
Рис. 2.10.1 Рис. 2.10.2
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине, принцип действия которой представлен на
рис. 2.10.2.
Системой за цикл от термостата с более низкой температурой Т 2 отнимается количество теплоты Q 2 и отдается термостату с более высокой температурой T 1 количество теплоты Q 1 . Для кругового процесса Q=A, но, по условию, Q=Q 2 –Q 1 <0, поэтому А<0 и Q 2 –Q 1 = -А, или Q 1 =Q 2 +А, т.е. количество теплоты Q 1 , отданное системой источнику теплоты при более высокой температуре T 1 , больше количества теплоты Q 2 , полученного от источника теплоты при более низкой температуре Т 2 , на величину работы, совершенной над системой. Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому. Это утверждение есть не что
иное, как второе начало термодинамики в формулировке Клаузиуса.
Однако второе начало термодинамики не следует представлять так, что оно совсем запрещает переход теплоты от менее нагретого тела к более нагретому. Ведь именно такой переход осуществляется в холодильной машине. Но при этом надо помнить, что внешние силы совершают работу над системой, т.е. этот переход не является единственным результатом процесса.
Основываясь на втором начале термодинамики, К а р н о вывел теорему носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т 1) и холодильников (Т 2 ), наибольшим кпд обладают обратимые машины; при этом кпд обратимых машин, работающих при одинаковых температурах нагревателей (Т 1) и холодильников (Т 2), равны друг другу и не зависят от природы рабочего тела.
Карно теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат, и называемый
циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
При изотермическом процессе U=const, поэтому количество теплоты Q 1 , полученное газом от нагревателя, равно работе расширения А 12 , совершаемой газом при переходе из состояния 1 в состояние 2:
 . (2.10.1)
. (2.10.1)
При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует, и работа расширения А 23 совершается за счет изменения внутренней энергии:
![]() .
.
§6 Энтропия
Обычно всякий процесс, при котором система переходит из одного состояния в другое, протекает таким образом, что нельзя провести этот процесс в обратном направлении так, чтобы система проходила через те же промежуточные состояния, и при этом в окружающих телах не произошли какие-либо изменения. Это связано с тем, что в процессе часть энергии рассеивается, например, за счет трения, излучения и т. п. Т. о. практически все процессы в природе необратимы. В любом процессе часть энергии теряется. Для характеристики рассеяния энергии вводится понятие энтропии. (Величина энтропии характеризует тепловое состояние системы и определяет вероятность осуществления данного состояния тела. Чем более вероятно данное состояния, тем больше энтропия.) Все естественные процессы сопровождаются ростом энтропии. Энтропия остается постоянной только в случае идеализированного обратимого процесса, происходящего в замкнутой системе, то есть в системе, в которой не происходит обмен энергией с внешними по отношению к этой системе телами.
Энтропия и ее термодинамический смысл:
Энтропия - это такая функция состояния системы, бесконечно малое изменение которой в обратимом процессе равно отношению бесконечно малого количества теплоты, введенного в этом процессе, к температуре, при которой оно вводилось.
В конечном обратимом процессе изменения энтропии может быть подсчитано по формуле:
![]()
где интеграл берется от начального состояния 1 системы до конечного состояния 2.
Поскольку энтропия есть функция состояния, то свойством интеграла является его независимость от формы контура (пути), по которому он вычисляется, следовательно, интеграл определяется только начальным и конечным состояниям системы.
- В любом обратимом процессе изменения энтропии равно 0
(1)
- В термодинамике доказывается, что S системы совершающей необратимой цикл возрастает
Δ S > 0 (2)
Выражения (1) и (2) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то её S может вести себя любым образом.
Соотношения (1) и(2) можно представить в виде неравенства Клаузиуса
Δ S ≥ 0
т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояния 2, то изменения энтропии
![]()
где dU и δA записывается для конкретного процесса. По этой формуле Δ S определяется с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропий. Найдем изменение энтропии в процессах идеального газа.
![]()
т.е. изменения энтропии S Δ S 1→2 идеального газа при переходе его из состояния 1 в состояния 2 не зависит от вида процесса.
Т.к. для адиабатического процесса δ Q = 0, то Δ S = 0 => S = const , то есть адиабатический обратимый процесс протекает при постоянной энтропии. Поэтому его называют изоэнтропийным.
При изотермическом процессе (T = const ; T 1 = T 2 : )
![]()
При изохорном процессе (V = const ; V 1 = V 2 ; )
![]()
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел входящих в систему. S = S 1 + S 2 + S 3 + ... Качественным отличием теплового движения молекул от других форм движения является его хаотичность, беспорядочность. Поэтому для характеристики теплового движения необходимо ввести количественную меру степени молекулярного беспорядка. Если рассмотреть какое-либо данное макроскопическое состояния тела с определенными средними значениями параметров, то оно есть нечто иное, как непрерывная смена близких микросостояний, отличающихся друг от друга распределением молекул в разных частях объема и распределяемой энергией между молекулами. Число этих непрерывно сменяющих друг друга микросостояний характеризует степень беспорядочности макроскопического состояния всей системы, w называется термодинамической вероятностью данного микросостояния. Термодинамическая вероятность w состояния системы — это число способов, которыми может быть реализовано данное состояния макроскопической системы, или число микросостояний, осуществляющих данное микросостояния (w ≥ 1, а математическая вероятность ≤ 1 ).
За меру неожиданности события условились принимать логарифм его вероятности, взятый со знаком минус: неожиданность состояния равна = -
Согласно Больцману, энтропия S системы и термодинамическая вероятность связаны между собой следующим образом:
где
- постоянная Больцмана (![]() ). Таким образом, энтропия определяется логарифмом числа состояния, с помощью которых может быть реализовано данное микросостояние. Энтропия может рассматриваться как мера вероятности состояния т/д системы. Формула Больцмана позволяет дать энтропии следующее статистическое толкования. Энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний реализующих данное микросостояние, тем больше энтропия. В состоянии равновесия системы - наиболее вероятного состояния системы - число микросостояний максимально, при этом максимальна и энтропия.
). Таким образом, энтропия определяется логарифмом числа состояния, с помощью которых может быть реализовано данное микросостояние. Энтропия может рассматриваться как мера вероятности состояния т/д системы. Формула Больцмана позволяет дать энтропии следующее статистическое толкования. Энтропия является мерой неупорядоченности системы. В самом деле, чем больше число микросостояний реализующих данное микросостояние, тем больше энтропия. В состоянии равновесия системы - наиболее вероятного состояния системы - число микросостояний максимально, при этом максимальна и энтропия.
Т.к. реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии - принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной.
§7 Второе начало термодинамики
Первое начало термодинамики, выражая закон сохранения энергии и превращения энергии, не позволяет установить направление протекания т/д процессов. Кроме того, можно представить множество процессов, не противоречащих I началу т/д, в которых энергия сохраняется, а в природе они не осуществляются. Возможные формулировки второго начало т/д:
1) закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимой процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает Δ S ≥ 0 (необратимый процесс) 2) Δ S ≥ 0 (S = 0 при обратимом и Δ S ≥ 0 при необратимом процессе)
В процессах, происходящих в замкнутой системе, энтропия не убывает.
2) Из формулы Больцмана S = , следовательно, возрастание энтропии означает переход системы из менее вероятного состояния в более вероятное.
3) По Кельвину: не возможен круговой процесс, единственным результатом которого является превращения теплоты, полученной от нагревателя в эквивалентную ей работу.
4) По Клаузиусу: не возможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Для описания т/д систем при 0 К используют теорему Нернста-Планка (третье начало т/д): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к 0 К
Из теоремы Нернста-Планка следует, что C p = C v = 0 при 0 К
§8 Тепловые и холодильные машины.
Цикл Карно и его к.п.д.
Из формулировки второго начала т/д по Кельвину следует, что вечный двигатель второго рода невозможен. (Вечный двигатель - это периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты.)
 Термостат
- это т/д система, которая может обмениваться теплотой с телами без изменения температуры.
Термостат
- это т/д система, которая может обмениваться теплотой с телами без изменения температуры.
Принцип действия теплового двигателя: от термостата с температурой Т 1 - нагревателя, за цикл отнимается количество теплоты Q 1 , а термостату с температурой Т 2 (Т 2 < Т 1) -холодильнику, за цикл передается количество теплоты Q 2 , при этом совершается работа А = Q 1 - Q 2
 Круговым процессом или циклом
называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме состояний цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1-2) и сжатия (2-1), работа расширения положительна А
1-2 > 0, т.к.
V
2
>
V
1
, работа сжатия отрицательна А
1-2 < 0, т.к.
V
2
<
V
1
. Следовательно, работа совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой 1-2-1. Если за цикл совершается положительная работа (цикл по часовой стрелке), то цикл называется прямым, если - обратный цикл (цикл происходит в направлении против часовой стрелки).
Круговым процессом или циклом
называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме состояний цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1-2) и сжатия (2-1), работа расширения положительна А
1-2 > 0, т.к.
V
2
>
V
1
, работа сжатия отрицательна А
1-2 < 0, т.к.
V
2
<
V
1
. Следовательно, работа совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой 1-2-1. Если за цикл совершается положительная работа (цикл по часовой стрелке), то цикл называется прямым, если - обратный цикл (цикл происходит в направлении против часовой стрелки).
Прямой цикл используется в тепловых двигателях - периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах - периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии равно нулю. Тогда І начало т/д для кругового процесса
Q = Δ U + A = A ,
Т. е. работа, совершаемая за цикл равна количеству полученной извне теплоты, но
Q = Q 1 - Q 2
Q 1 - количество теплоты, полученное системой,
Q 2 - количество теплоты, отданное системой.
Термический к.п.д. для кругового процесса равен отношению работы, совершенной системой, к количеству теплоты, подведенному к системе:
![]()
Чтобы η = 1, должно выполняться условие Q 2 = 0, т.е. тепловой двигатель должен иметь один источник теплоты Q 1 , но это противоречит второму началу т/д.
Процесс обратный происходящему в тепловом двигателе, используется в холодильной машине.
 От термостата с температурой Т
2 отнимается количество теплоты
Q
2
и передается термостату с температурой
T
1
, количество теплоты
Q
1
.
От термостата с температурой Т
2 отнимается количество теплоты
Q
2
и передается термостату с температурой
T
1
, количество теплоты
Q
1
.
Q = Q 2 - Q 1 < 0, следовательно A < 0.
Без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому.
Основываясь на втором начале т/д, Карно вывел теорему.
Теорема Карно: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т 1) и холодильников (Т 2), наибольшим к.п.д. обладают обратимые машины. К.П.Д. обратимых машин при равных Т 1 и Т 2 равны и не зависят от природы рабочего тела.
Рабочее тело - тело, совершающее круговой процесс и обменивающиеся энергией с другими телами.
Цикл Карно - обратимый наиболее экономичный цикл, состоящий из 2-х изотерм и 2-х адиабат.
 1-2-изотермическое расширения при Т
1 нагревателя; к газу подводится теплота
Q
1
и совершается работа
1-2-изотермическое расширения при Т
1 нагревателя; к газу подводится теплота
Q
1
и совершается работа
![]()
2-3 - адиабат. расширение, газ совершает работу A 2-3 >0 над внешними телами.
3-4-изотермическое сжатие при Т
2 холодильника; отбирается теплота
Q
2
и совершается работа
![]() ;
;
4-1-адиабатическое сжатие, над газом совершается работа A 4-1 <0 внешними телами.
При изотермическом процессе U = const , поэтому Q 1 = A 12
![]() 1
1
При адиабатическом расширении Q 2-3 = 0, и работа газа A 23 совершается за счет внутренней энергии A 23 = - U
![]()
Количество теплоты Q 2 , отданное газом холодильнику при изотермическом сжатии равно работе сжатия А 3-4
![]() 2
2
Работа адиабатического сжатия
![]()
Работа, совершаемая в результате кругового процесса
A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2
и равна площади кривой 1-2-3-4-1.
Термический к.п.д. цикла Карно
![]()
Из уравнения адиабаты для процессов 2-3 и 3-4 получим
Тогда
![]()
![]()
т.е. к.п.д. цикла Карно определяется только температурами нагревателя и холодильника. Для увеличения к.п.д. нужно увеличивать разность Т 1 - Т 2 .
******************************************************* ******************************************************
Круговой процесс - процесс, при котором газ, пройдя через ряд состояний, возвращается в исходное.
Если круговой процесс на диаграмме P-V протекает по часовой стрелке, то часть тепловой энергии, полученной от нагревателя, превращается в работу. Так работает тепловая машина.
Если круговой процесс на диаграмме P-V протекает против часовой стрелки, то тепловая энергия передается от холодильника (тела с меньшей температурой) к нагревателю (телу с большей температурой) за счет работы внешней силы. Так работает холодильная машина.
Цикл Карно́ - идеальный термодинамический цикл . Тепловая машина Карно , работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов .
Цикл Карно назван в честь французского военного инженера Сади Карно , который впервые его исследовал в 1824 году .
Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этом энтропияадиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
 | Цикл Карно состоит из четырёх стадий: 1. Изотермическое расширение (на рисунке - процесс A→Б). В начале процесса рабочее тело имеет температуру, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты . При этом объём рабочего тела увеличивается. 2. Адиабатическое (изоэнтропическое) расширение (на рисунке - процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника. 3. Изотермическое сжатие (на рисунке - процесс В→Г). Рабочее тело, имеющее к тому времени температуру, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты . 4. Адиабатическое (изоэнтропическое) сжатие (на рисунке - процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя. |
Вычисление совершаемой веществом работы, за единичный цикл Карно при постоянных не одинаковых температурах Т1 и Т2 от нагревателя и холодильника, можно вычислить с помощью расчета:
А = Q1 - Q2 = (Т1-Т2/T1) *Q1 Данная работа количественно приравнивается к площади АВСD с ограничивающими отрезками в виде изотерм и адиабат которые и создают данный цикл.
Теорема Карно (с выводом).
Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей T 1 и холодильников T 2 , наибольшим КПД обладают обратимые машины. При этом КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника.
Для построения рабочего цикла использует обратимые процессы. Например, цикл Карно состоит из двух изотерм (1–2, 2-4) и двух адиабат (2-3, 4–1), в которых теплота и изменение внутренней энергии полностью превращаются в работу (рис. 19). 
Рис. 19. Цикл Карно
Общее изменение энтропии в цикле: ΔS=ΔS 12 +ΔS 23 +ΔS 34 +ΔS 41.
Так как мы рассматриваем только обратимые процессы, общее изменение энтропии ΔS=0.
Последовательные термодинамические процессы в цикле Карно:
Общее изменение энтропии в равновесном цикле: ΔS=(|Q 1 |/T 1)+0-(|Q 2 |/T 2)+0=0⇒T 2 /T 1 =|Q 2 |/|Q 1 |,
поэтому: η max =1-(T 2 /T 1) - максимальный КПД теплового двигателя.
Следствия:
1. КПД цикла Карно не зависит от рода рабочего тела.
2. КПД определяется только разницей температур нагревателя и холодильника.
3. КПД не может быть 100% даже у идеальной тепловой машины, так как при этом температура холодильника должна быть T 2 =0, что запрещено законами квантовой механики и третьим законом термодинамики.
4. Невозможно создать вечный двигатель второго рода, работающий в тепловом равновесии без перепада температур, т.е. при T 2 =T 1 , так как в этом случае η max =0.
II начало термодинамики.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоречащих первому началу, в которых энергия сохраняется, а в природе они не осуществляются. Появление второго начала термодинамики связано с необходимостью дать ответ на вопрос, какие процессы в природе возможны, а какие нет. Второе начало термодинамики определяет направление протекания термодинамических процессов.
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать более краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
Формула Больцмана (2.134) позволяет объяснить постулируемое вторым началом термодинамики возрастание энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Таким образом, формула Больцмана позволяет дать статистическое толкование второго начала термодинамики. Оно, являясь статистическим законом, описывает закономерности хаотического движения большого числа частиц, составляющих замкнутую систему.
Укажем еще две формулировки второго начала термодинамики:
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Можно довольно просто доказать эквивалентность формулировок Кельвина и Клаузиуса. Кроме того, показано, что если в замкнутой системе провести воображаемый процесс, противоречащий второму началу термодинамики в формулировке Клаузиуса, то он сопровождается уменьшением энтропии. Это же доказывает эквивалентность формулировки Клаузиуса (а следовательно, и Кельвина) и статистической формулировки, согласно которой энтропия замкнутой системы не может убывать.
В середине XIX в. возникла проблема так называемой тепловой смерти вселенной. Рассматривая Вселенную как замкнутую систему к применяя к ней второе начало термодинамики, Клаузиус свел его содержание к утверждению, что энтропия Вселенной должна достигнуть своего максимума. Это означает, что со временем все формы движения должны перейти в тепловую. Переход же теплоты от горячих тел к холодным приведет к тому, что температура всех тел во Вселенной сравняется, т. е. наступит полное тепловое равновесие и все процессы во Вселенной прекратятся – наступит тепловая смерть Вселенной. Ошибочность вывода о тепловой смерти заключается в том, что бессмысленно применять второе начало термодинамики к незамкнутым системам, например к такой безграничной в бесконечно развивающейся системе, как Вселенная.
Энтропия по Клаузиусу.
К макроскопическим параметрам термодинамической системы относятся давление, объём и температура. Однако существует ещё одна важная физическая величина, которую используют для описания состояний и процессов в термодинамических системах. Её называют энтропией.
Впервые это понятие ввёл в 1865 г. немецкий физик Рудольф Клаузиус. Энтропией он назвал функцию состояния термодинамической системы, определяющую меру необратимого рассеивания энергии.
Что же такое энтропия? Прежде чем ответить на этот вопрос, познакомимся с понятием «приведенной теплоты». Любой термодинамический процесс, проходящий в системе, состоит из какого-то количества переходов системы из одного состояния в другое. Приведенной теплотой называют отношение количества теплоты в изотермическом процессе к температуре, при которой происходит передача этой теплоты.
Q" = Q/T .
Для любого незамкнутого термодинамического процесса существует такая функция системы, изменение которой при переходе из одного состояния в другое равно сумме приведенных теплот. Этой функции Клаузиус дал название «энтропия » и обозначил её буквой S , а отношение общего количества теплоты ∆Q к величине абсолютной температурыТ назвал изменением энтропии .
Обратим внимание на то, что формула Клаузиуса определяет не само значение энтропии, а только её изменение.
Что же представляет собой «необратимое рассевание энергии» в термодинамике?
Одна из формулировок второго закона термодинамики выглядит следующим образом: "Невозможен процесс, единственным результатом которого является превращение в работу всего количества теплоты, полученного системой ". То есть часть теплоты превращается в работу, а какая-то её часть рассеивается. Этот процесс необратим. В дальнейшем рассеиваемая энергия уже не может совершать работу. Например, в реальном тепловом двигателе рабочему телу передаётся не вся теплота. Часть её рассеивается во внешнюю среду, нагревая её.
В идеальной тепловой машине, работающей по циклу Карно, сумма всех приведенных теплот равна нулю. Это утверждение справедливо и для любого квазистатического (обратимого) цикла. И неважно, из какого количества переходов из одного состояния в другое состоит такой процесс.
Если разбить произвольный термодинамический процесс на участки бесконечно малой величины, то приведенная теплота на каждом таком участке будет равна δQ/T . Полный дифференциал энтропии dS = δQ/T .
Энтропию называют мерой способности теплоты необратимо рассеиваться. Её изменение показывает, какое количество энергии беспорядочно рассеивается в окружающую среду в виде теплоты.
В замкнутой изолированной системе, не обменивающейся теплом с окружающей средой, при обратимых процессах энтропия не изменяется. Это означает, что дифференциал dS = 0 . В реальных и необратимых процессах передача тепла происходит от тёплого тела к холодному. В таких процессах энтропия всегда увеличивается (dS ˃ 0 ). Следовательно, она указывает направление протекания термодинамического процесса.
Формула Клаузиуса, записанная в виде dS = δQ/T , справедлива лишь для квазистатических процессов. Это идеализированные процессы, являющиеся чередой состояний равновесия, следующих непрерывно друг за другом. Их ввели в термодинамику для того, чтобы упростить исследования реальных термодинамических процессов. Считается, что в любой момент времени квазистатическая система находится в состоянии термодинамического равновесия. Такой процесс называют также квазиравновесным.
Конечно, в природе таких процессов не существует. Ведь любое изменение в системе нарушает её равновесное состояние. В ней начинают происходить различные переходные процессы и процессы релаксации, стремящиеся вернуть систему в состояние равновесия. Но термодинамические процессы, протекающие достаточно медленно, вполне могут рассматриваться как квазистатические.
На практике существует множество термодинамических задач, для решения которых требуется создание сложной аппаратуры, создание давления в несколько сот тысяч атмосфер, поддержание очень высокой температуры в течение длительного времени. А квазистатические процессы позволяют рассчитать энтропию для таких реальных процессов, предсказать, как может проходить тот или иной процесс, реализовать который на практике очень сложно.






